|
1 はじめに
熱プラズマは局所熱平衡状態(LTE)に近く,高エネルギー密度および高温を有していることから,大量の廃棄物を処理することに適している.さらに高温の状態から急冷することによって,有害な副生成物の生成を阻止することもできる.
プロセスの迅速なスタートアップやシャットダウンが可能であることも廃棄物処理に適している理由である.また,他の廃棄物処理方法に比べてガスの使用量が少ないので,排ガスシステムへの負担が小さいことから考えても熱プラズマには廃棄物処理における優位性がある.
熱プラズマの優位性は廃棄物を処理するときの雰囲気を自由に選択できることにもある.熱プラズマによる有機系廃棄物の処理では酸化反応によって分解を促進する場合が多いが,アルゴンを用いた不活性雰囲気,水素を用いた還元雰囲気なども自由に選択することができる.有機系廃棄物処理プロセスの可能性を広げることにおいて,熱プラズマは好都合である.
熱プラズマによる有機系廃棄物の処理では,分解が瞬時に行われる高温領域でのプロセスよりも,プラズマフレーム下流の低温領域で再結合反応を抑制するプロセスが重要となる.この点が非平衡プラズマによる有機系廃棄物の処理と異なる点である.また,燃焼反応も高温を利用するという点では熱プラズマと類似の有機物分解プロセスであるが,燃焼プロセスでは燃焼ガス中に生じる物質によって目的反応が阻害されてしまう.熱プラズマではそのような作用がないことが特長である.
2.水プラズマの発生方法
2.1 直流アーク放電による水プラズマ
水は豊富に存在する常温で安定した化合物であるが,プラズマ状態では活性の強いOラジカル,Hラジカル,OHラジカルが発生する.これらの高活性なラジカルを利用することによって新しい廃棄物処理プロセスの展開が可能となるが,もともと水を使ったプラズマプロセッシングとしては,水によるアークの安定化の作用を目指した研究が進められていた[1].プラズマ溶射を目的として,チェコのInstitute
of Plasma Physicsでは水プラズマ溶射装置を開発し,多くの研究成果を発表している[2-7].
水プラズマの発生方法として,電極をアークの熱から保護するための冷却水を放電領域に直接吹き込み,プラズマガスとして使用する方法が開発されている[8].この水プラズマ発生装置(図1)では陰極にハフニウムを用いており,強い酸化性の高温の水蒸気でも長時間の耐久性を有している.陽極は銅製で,冷却水タンク上部まで伸びている.また,吸湿材によって冷却水がトーチ上部まで吸い上げられている.アークによって発生した熱は主に陽極を伝わって冷却水を加熱し,吸湿材を通って陽極に達した冷却水がそのままプラズマガスとなり,水プラズマを定常的に発生する.この方式では冷却水による電極からの熱損失がなくなるため,90%以上の熱効率が得られる.さらにガスボンベなどの外部からの作動ガスの供給が不要となるので,通常の水だけでプラズマを発生することができ,可搬式の水プラズマ発生装置への展開も容易となる.
しかし,液体の水を放電領域近傍まで導入するため,通常のアーク放電とは異なった数10 kHzの変動現象が確認されており[9],アークの挙動が未解明であるという課題も残されている.このような数十kHzのアークの変動はプロセッシングに影響を与えるが,溶射の分野では逆にアーク電圧や電流の変動現象を測定して電極変動を解析することにより,溶射被膜の特性を推測する研究も試みられている[10].
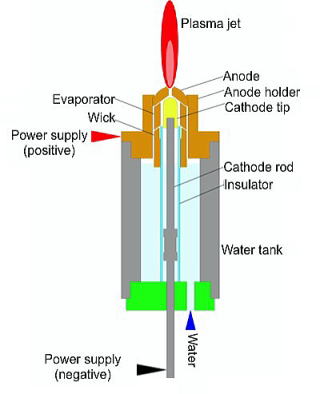 図1 直流アーク放電による水プラズマトーチ 図1 直流アーク放電による水プラズマトーチ
2.2 直流アーク放電による水蒸気プラズマ
直流アーク放電のプラズマジェットに水蒸気を吹き込むことによって,Kimら[11],Glockerら[12]は廃棄物処理への応用を検討した.通常,水蒸気を用いたプラズマを発生するには,このようにアルゴンプラズマなどに水蒸気を吹き込むが,高温の水蒸気によって陰極の金属が損耗するために,アルゴンや窒素を陰極の周囲にシールドガスとして流すことが必要となる.また,水蒸気を発生するための装置が別途必要となり,加えて水蒸気の凝縮防止のために装置全体を100℃以上に保つ必要があるなど,大掛かりな装置になってしまうといった問題点がある.
このように水蒸気をアルゴンなどで発生した熱プラズマの高温領域に吹き込み,水蒸気をプラズマ化する方法は「水蒸気プラズマ」と呼ばれる.一方,図1で示したように液体の水をプラズマの高温領域に供給し,瞬時に水素と酸素に分解する方法は「水プラズマ」と呼ばれ,「水蒸気プラズマ」とは原理的にも特性も異なるものである.
直流アーク放電を利用したプラズマは高出力化や高密度化が可能な実用的かつ工業的な高温熱源である.特に陽極部と陰極部の間でアークを発生させ,ノズル部分での熱的ピンチ効果を利用して高温の熱プラズマ流を得る非移行式アークは,その形状から処理する物質の制限が少なく,廃棄物処理のみならず各種の材料プロセッシングにも広く用いられているが,熱効率は30%程度と低い.
また,安定に見えるプラズマジェットも高速度カメラで観察すると,波を打つような不安定挙動を示していることがわかっている[13].この現象は,陽極におけるアークの付着点が軸方向や周方向に運動していることに起因する.このようなプラズマジェットの不安定現象が原因となって,プラズマの中心に供給した物質でさえ,アークの高温領域だけではなく,低温領域も通過することになる.これは処理物質の加熱履歴が均一にならず,廃棄物の分解効率が予想より悪くなる可能性があることを意味している.
2.3 高周波放電による水蒸気プラズマ
直流アーク放電によるプラズマシステムと比べると,高周波(RF)プラズマシステムは装置が高価であるというデメリットがある.また,プラズマ中に供給する処理物質によってプラズマの安定性が失われることが本質的に避けられないことも留意すべき点である.しかし,RFプラズマは無電極放電によるプラズマ発生なので,電極の保護などの問題がないことから,水蒸気のみを利用したプラズマ発生が可能であり,新しい廃棄物処理プロセスの展開が期待できる[14].
RFプラズマによる水蒸気プラズマシステムの成功例としては,北九州市のエコタウンにおいて西日本家電リサイクルが行っているフロン分解プラントがある.2000年4月から実証試験が開始され,各種回収フロンの分解性能評価を行い,2004年に商用プラントとして成立している.このプラントの特徴は,フロン回収事業所においてフロン分解までのすべてを行うことであり,フロンを移動する際のフロン拡散の危険性の低減や,輸送によるCO2排出量をなくすことができる.
2.4 マイクロ波放電による水蒸気プラズマ
大気圧マイクロ波加熱放電は,方形導波管を通じてマイクロ波(2.45 GHz)を同軸導波管に伝播し,ノズルにより絞られたトーチ先端部においてマイクロ波の電場強度を強めることにより生成される.マイクロ波プラズマは他の熱プラズマほどの高温ではないが,マイクロ波独特の炎のようなプラズマを生成する.マイクロ波プラズマは,イオンや電子が支配的に存在している領域が比較的狭いこと,また下流に向かって解離した原子が支配的に存在する領域が広がっていることから,プラズマ源としてよりも反応性が極めて高い高密度ラジカル源としての利用が期待されている.
フロンと水蒸気の混合ガスをガラス管に引き込み,そこにマイクロ波を当てて,フロンを分解する方法が検討されている[15,16].しかしマイクロ波放電はRFプラズマや直流アーク放電プラズマと比べて高出力の電源が少なく,またプラズマのガス温度も低いことから,マイクロ波放電を用いた廃棄物処理プラズマの産業的な成功例はない.
3.水プラズマの特長
有機系廃棄物処理において,水プラズマには2つの特長がある.1つ目はOラジカルとHラジカルによる副生成物の抑制である.2つ目はOHラジカルの強い酸化ポテンシャルを利用した有機物の分解である.
水プラズマが有機系廃棄物処理に適している理由を熱力学的観点から考えてみる.このような検討には,ギブスの自由エネルギー最小化法によって,プラズマの組成を平衡計算で求める方法が役に立つ.プラズマ中で反応物質の滞留時間が短い場合や,分解生成物を下流で急冷する場合には化学反応が熱力学的平衡に達しない場合があるが,プラズマ中の反応挙動や分解生成物を大まかに捉えるためには有効な方法である.
水プラズマの平衡組成を図2 [17]に示す.水は2,000 K以上になると解離し,8,000 K以上になると電離したHイオンとOイオンが現れてくる.なお,OHラジカルは3,000
Kから4,000 Kの間で極大値を持つ.特に酸化反応においては,OラジカルよりもOHラジカルのほうが低温で安定であり,酸化ポテンシャルが大きいことから,ほとんどの有機物はOHラジカルによってCO2とH2Oに分解することができる.
フロンを熱分解すると,分解後の低温領域で炭素とハロゲンの再結合反応を起こし,別のフロンであるCF4などを再結合してしまうことになる.これを防ぐためには, フロンを水蒸気とともに分解することが有効である.つまり,水蒸気の添加によってOラジカルとHラジカルが発生するので,CF4ではなくHFを合成し,副生成物はどの温度域でも再結合されない.このように水蒸気を用いたプラズマをフロンなどのようにハロゲンを含む有機物の分解に用いることは理にかなっている方法である[17-19].同様の方法はPCB分解にも適用できる[11].
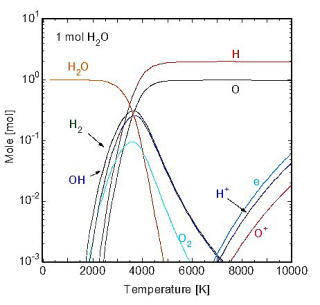 図2 水プラズマの平衡組成 図2 水プラズマの平衡組成
4.水プラズマによる排水の処理
環境汚染物質の処理が重要な課題となっているなかで,最近は工場等から出る排水処理が特に問題となっている.微量でも極めて有害な環境汚染物質が含まれていることがあり,現在は有機物を含む排水処理には生物的処理方法や活性炭処理が広く利用されている.しかしフェノールやトルエンなどの芳香族化合物が高濃度で含まれている場合には従来の生物的処理方法では対応できない.
そこで最近はAOP (Advanced Oxidation Process, 促進酸化処理)による排水処理が行われている.AOPはオゾンや過酸化水素などの化学種を添加し,UV照射などと組み合わせることによってOHラジカルを生成し,効率的に有機物を分解する方法である.AOPでは危険で高価な薬剤などを添加することが多いが,水プラズマによる排水処理は,薬品等を添加することなく,排水中の有機物を迅速に分解できることが特長である[20,21].
直流アーク放電の水プラズマによってフェノール水溶液を分解し,処理後のフェノール水溶液のCOD (Chemical Oxygen Demand,化学的酸素要求量)の値を計測した結果を図3
[21]に示す.分解に有効な水プラズマの高温領域におけるフェノールの滞留時間は約1 msであるが,このような短時間でもフェノール水溶液の分解前の105
mg/LというCODを,アーク電流が6 Aのときに99.1%,8 Aのときに99.9%減少することができている.なお,分解後のフェノール水溶液のpHは4.5であり,さらに銀鏡反応を示していることから,副生成物としてギ酸が微量に含まれていると考えられる.このプラズマ処理後のわずかなCODは,この微量のギ酸が原因であると考えられる.
水プラズマによってフェノール水溶液を分解し,そのときに発生したガスを分析することによって,フェノールの分解機構を明らかにすることができる.フェノール水溶液の分解生成ガスの質量分析では,アーク電流が8 Aの場合にはH2, CO2, CO, O2, CH4のピークのみが確認できることから,フェノールが完全に分解されていることがわかる.アーク電流を6 Aに低下させるとC2H2, C5H5, C6H6のピークも検出されるようになり,フェノールが十分に酸化されなかったことが示されている.
また,この生成ガスをガスクロマトグラフにより定量分析したところ,アーク電流の増加に伴ってH2やCO2は増加したが,COは減少した.アーク電流の増加によってプラズマ中に存在するOラジカルやOHラジカルが増加し,酸化雰囲気が強くなっているためと考えられる.
以上の実験結果から考えると,プラズマ中では主にOラジカルによってフェノールが酸化され,フェノキシルラジカルを経由して分解されることが主な反応ルートであると考えられる.一部はベンゼンを経由してギ酸やホルムアルデヒドが生成される反応ルートもある.
フェノール排水処理における生物的処理,AOP,触媒,非平衡プラズマ,陽極酸化などの各種の方法に加えて,水プラズマによる分解における適用濃度と処理速度を図4
[22]に示す.通常の方法では分解が困難である高濃度フェノール水溶液を水プラズマで迅速に分解することができることから,水プラズマによる排水処理プロセスは実現の可能性があると考えられる.
また,実験値から推算した水プラズマによるフェノール分解におけるエネルギー効率は8.1 g/kWhであった.なお,コロナ放電によるフェノール水溶液分解では3.48-22.67
g/kWh [23,24],パルス放電では0.74-2.27 g/kWh [25]のエネルギー効率であることから,水プラズマのエネルギー効率は他の非平衡プラズマやAOPの値とほぼ同等かやや高い値である.さらに水プラズマの場合には,分解後の副生成物の発生がほとんど見られず,分解によるCODやTOCの除去率も99.9%以上という高い値が得られているが,他の非平衡プラズマやAOPによる分解では,ヒドロキノン,カテコール,ベンゾキノンなどの副生成物が発生しており,分解によるCODやTOCの除去率が低い値となっている.完全なフェノールの分解を行うには水プラズマによる分解システムが適している.
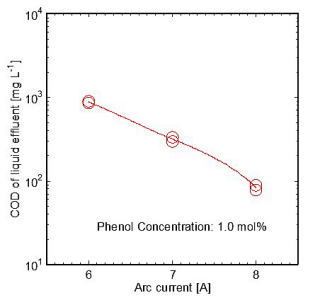 図3 水プラズマによる分解後のフェノール水溶液のTOCとTCの値の測定結果 図3 水プラズマによる分解後のフェノール水溶液のTOCとTCの値の測定結果
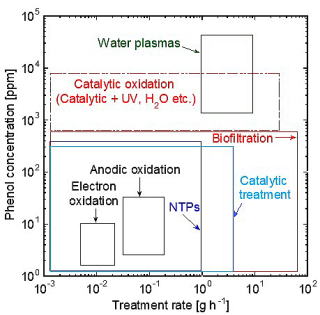 図4 フェノール含有排水処理に各種方法適用可能濃度と処理速度 図4 フェノール含有排水処理に各種方法適用可能濃度と処理速度
5.有機系廃棄物からの水素製造
プラズマによる廃棄物処理システムは,従来の方法では扱うことができなかった難処理廃棄物を分解できるという利点があるが,廃棄物を単に分解・無害化するだけではなく,廃棄物から有価なものを生み出すリサイクルプロセスを実現できるのも熱プラズマの特長である.現在,最も注目されている廃棄物処理プロセスは,ゴミをプラズマで分解することによって水素を取り出す技術である.
高温熱分解による廃棄物からの水素製造方法は数多く行われているが,水蒸気を用いてプラズマを発生し,そのプラズマを用いて廃棄物から水素を製造する方法は,プラズマの放電領域で有機物を高速で分解できるので,分解効率が高い方法である。特に水プラズマ自体からも水素を発生するので,廃棄物を処理して副生水素を製造するプロセスは実現の可能性がある.不要な厄介者であったゴミを,これからはプラズマ技術によって立派な資源とすることができる.
なお,一部の研究のなかには廃棄物ではなく有価の物質をプラズマで分解して水素を製造することを目的とした研究例があるが,有価の対象物質をプラズマで分解して水素を製造しても,システム全体としてのエネルギー収支はマイナスになるので全く意味がない.プラズマで水素を製造してシステム全体として意味があるのは,あくまでも廃棄物からの副生水素の製造に限られる.
直流アーク放電の水プラズマ発生方法では,エタノール,メタノール,アセトン,グリセリンなどの水溶液を用いてもプラズマを発生することができる.これらの水溶液を液体の有機系廃棄物のモデルとして,水プラズマによる水素製造の検討が行われている[26-29].
対象物質のひとつであるアセトンは分子内にCH3基を2つ持っているので,分解機構におけるCH3基の役割を調べることに適している.また,アセトンは工業や医学など領域に幅広く使用されているが,揮発性有機化合物(VOC)と規定されているために,適切なアセトンの分解方法が必要となっている.VOCは浮遊粒子状物質や光化学オキシダントによる大気汚染の原因物質のひとつであることから,その排出抑制のみならず,分解技術の研究も重要である.
次に,グリセリンを有機系廃棄物の例として考える.グリセリンは分子内にOH基を3つ持っていることから,分解機構におけるOH基の役割を調べることに適している.さらにバイオディーゼル製造プロセスの副生成物としてグリセリンが生成されているが,このグリセリンには有効な用途がなく,その処分が困難な状況である.よってグリセリンの分解機構を調べることは,廃油等からの水素製造技術としても重要である.
直流アーク放電の水プラズマによってアセトン,グリセリン,エタノール,メタノールの水溶液を分解し,処理後のTOCの値を計測した結果を図5 [29]に示す.通常は有機物の濃度が高くなると還元雰囲気が強くなるので分解率が下がり,TOCの値は高くなる.この図からわかるように,アセトン,エタノール,メタノールの濃度が高いほどTOCは大きくなるが,グリセリンだけは逆の傾向を示す.これはグリセリン濃度の増加によって,グリセリン由来のOHラジカルが増加し,分解が進んでいるためである.このように,グリセリンの分解ではグリセリンから発生するOHラジカルが重要な役割を果たしている.
アセトン水溶液の分解によって生成したガスをガスクロマトグラフィにより定量分析したところ,図6 [28]に示すようにアセトン濃度の増加に伴い,H2,CO2は減少しているが,CO,CH4,C2H2は増加している.グリセリン濃度の増加によって,プラズマ中に存在する炭素成分が増えるためである.水プラズマによる有機物の分解では,このように酸化性の生成物と還元性の生成物が共存していることが特徴である.
次に,グリセリン水溶液の分解によって生成したガスをガスクロマトグラフィにより定量分析した結果を図7 [29]に示す.アセトンの分解と比べると,生成ガス中のCO2/COの値がグリセリンの分解のほうが高い値になっている.これは水プラズマ中におけるグリセリン分解の雰囲気が,より強い酸化性になっているためであり,グリセリンから発生するOHラジカルが分解において重要であることを示している.なお,アセトンの分解でもグリセリンの分解でも,生成ガスの65%以上はH2であり,有機系廃棄物からの副生水素の製造が可能であることが示されている.
グリセリン水溶液の分解によって生成した液体を高速液体クロマトグラフィによって定量分析したところ,液体にはホルムアルデヒドやギ酸が含まれているが,グリセリン濃度の増加に伴い,ギ酸の濃度が増加し,ホルムアルデヒドの濃度が減少していることが示されている.この結果からもグリセリン由来のOHラジカルによる分解が重要であることがわかる.
以上の実験結果をまとめると,水プラズマ中における有機物の分解機構が見えてくる.グリセリンは水プラズマ中の高温によってCH2ラジカルとOHラジカルを生成する.水プラズマからのOラジカルとOHラジカルに加えて,グリセリン由来のOHラジカルによる酸化によってCOやCO2を生成することが主な分解ルートである.
アセトンは水プラズマ中の熱分解によってCH3ラジカルを生成し,さらに水プラズマのOラジカルによる酸化によってCOやCO2を生成することが主な分解ルートである.なお,メタノールの分解では煤は発生しないが,アセトン,エタノールの分解では顕著な煤の発生が観測されている.これは高温中で生成したCH3が起点となって煤を生成するためである.
水プラズマ技術は,廃プラスチック等の有機系廃棄物から水素を製造する高温熱分解技術のひとつとして考えられる.水プラズマを用いる方法は,他の燃焼法よりも水素の製造量が多く,装置が小さくてもよいという利点がある.特に廃棄物処理を現地で分散型のシステムとして処理することも可能となるので,今後のプラズマ処理システムの新たな展開が期待できる.
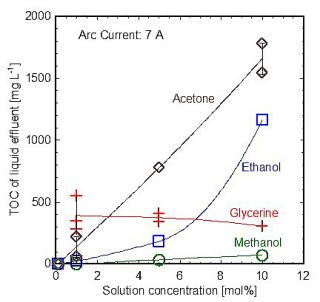 図5 水プラズマによるアセトン,グリセリン,エタノール,メタノール水溶液の分解後の液体のTOC 図5 水プラズマによるアセトン,グリセリン,エタノール,メタノール水溶液の分解後の液体のTOC
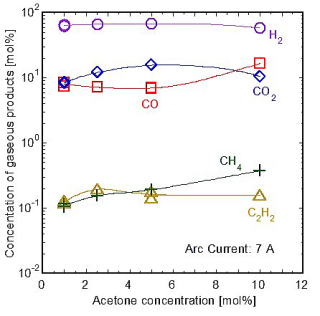 図6 水プラズマによるアセトン水溶液分解後の生成ガスの組成 図6 水プラズマによるアセトン水溶液分解後の生成ガスの組成
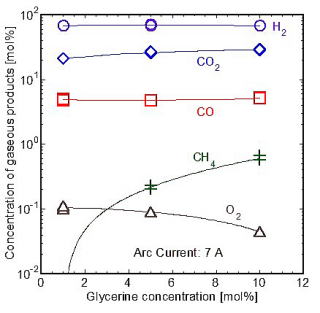 図7 水プラズマによるグリセリン水溶液分解後の生成ガスの組成 図7 水プラズマによるグリセリン水溶液分解後の生成ガスの組成
6.まとめ
環境問題は大きな社会問題となっており,その解決のための先端基盤技術のひとつとして熱プラズマ技術開発が行われている.プラズマを用いた新しい廃棄物処理プロセスは,これからの資源循環型社会構築に対して一石を投じるものであると考えられる.
従来,熱プラズマはその高温という特長を利用しているものがほとんどであるが,熱プラズマには高化学活性という魅力的な特長もある.熱プラズマに存在している荷電粒子やラジカルを上手に利用して,高化学活性であるという特長を活用すれば,新しい廃棄物処理プロセスを開発することが可能である.
また,熱プラズマを廃棄物処理システムとして実用化するのに重要な点はコストである.熱プラズマプロセスは従来からコストが高いものと扱われてきたが,熱プラズマが有する高温と高化学活性という特長を活用すれば,廃棄物処理装置全体としてのコストを低減できる可能性がある.またコストの点だけではなく,熱プラズマにしか実現できないプロセスがあることも重要な点である.
参考文献
[1] Kotalik, P., J. Phys. D: Appl. Phys., 39 (2006) 2522.
[2] Hrabovsky, M., Konrad, M., Kopecky, V., and Sember, V., IEEE Trans. Plasma Sci., 25 (1997) 833.
[3] Hrabovsky, M., Pure Appl. Chem., 70 (1998) 1157.
[4] Jenista, J., J. Phys. D: Appl. Phys., 32 (1999) 2777.
[5] Hrabovsky, M., Pure Appl. Chem., 74 (2002) 429.
[6] Hravobsky, M., Konrad, M., Kopecky, V., Hlina, M., Kavka, T., Chumak,
O., Oost, G.V., Beeckman, E., and Defoort, B., High Temp. Mater. Process., 10 (2006) 557.
[7] Hrabovsky, M., Kopecky, V., Sember, V., Kavka, T., Chumak, O., and Konrad, M., IEEE Trans. Plasma Sci., 34 (2006) 1566.
[8] Watanabe, T., ASEAN J. Chem. Eng., 5 (2005) 30.
[9] Li, T.M., Choi, S., and Watanabe, T., Plasma Sci. Technol., 14 (2012) 1097.
[10] Watanabe, T., Wang, X.C., Heberlein, J., and Pfender, E., Thin Solid Films,
316 (1998) 169.
[11] Kim, S.W., Park, S.H., and Kim, J.H., Vacuum, 70 (2003) 59.
[12] Glocker, B., Nentwig, G., and Messerchmid, E., Vacuum, 59 (2000) 35.
[13] Pfender, E., Plasma Chem. Plasma Process., 19 (1999) 1.
[14] Tang, L. and Huang, H., Fuel Process. Technol., 88 (2007) 549.
[15] 別所正博, 日本学術振興会プラズマ材料科学第153委員会第57回研究会資料 (2002) 29.
[16] Uhm, H.S., Kim, J.H., and Hong, Y.C., Phys. Plasmas, 14 (2007) 073502?1.
[17] Watanabe, T. and Tsuru, T., Thin Solid Films, 516 (2008) 4391.
[18] Narengerile, Saito, H., and Watanabe, T., Thin Solid Films, 518 (2009)
929.
[19] Narengerile, Saito, H., and Watanabe, T., Plasma Chem. Plasma Process.,
30 (2010) 813.
[20] Yuan, M.H., Narengerile, Watanabe, T., and Chang, C.Y., Env. Sci. Technol., 44 (2010) 4710.
[21] Narengerile, Yuan, M.H., and Watanabe, T., Chem. Eng. J., 168 (2011) 985.
[22] Narengerile, 博士論文, 東京工業大学 (2012).
[23] Ognier, S., Iya-sou, D., Fourmond, C., and Cavadias, S., Plasma Chem. Plasma Process., 29 (2009) 261.
[24] Hoeben, W.F.L.M., van Veldhuizen, E.M., Rutgers, W.R., and Kroesen, G.M.W., J. Phys. D: Appl. Phys., 32 (1999) L133.
[25] Hoeben, W.F.L.M., van Veldhuizen, E.M., Rutgers, W.R., Cramers, C.A.M.G., and Kroesen, G.M.W., Plasma Sources Sci. Technol., 9 (2000) 361.
[26] Nishioka, H., Saito, H., and Watanabe, T., Thin Solid Films, 518 (2009) 924.
[27] Narengerile, Nishioka, H., and Watanabe, T., Jpn. J. Appl. Phys., 50 (2011)
08JF13.
[28] Narengerile and Watanabe, T., Chem. Eng. Sci., 69 (2012) 296.
[29] Watanabe, T., Narengerile and Nishioka, H., Plasma Chem. Plasma Process.,
32 (2012) 123.
もっと詳しく調べたい方は,こちらの解説を参考にしてください。
|